Como é realizada a centrifugação por gradiente de densidade?
6 min de leitura
A centrifugação é o processo utilizado para separar partículas de diferentes densidades, através da força centrífuga. Dessa forma, é possível separar diversos elementos de uma mistura, seja líquido-líquido ou líquido-sólido.
Quando uma amostra é colocada em uma centrífuga e a força é aplicada, elementos de maior densidade se movem em direção ao fundo do recipiente, enquanto os de menor densidade ficam próximos a superfície.
Vamos tomar o exemplo de um recipiente com areia e água. Ao serem misturados e depois deixados em repouso, percebemos que a areia sedimenta rapidamente para o fundo, devido à influência da gravidade.
No entanto, para as macromoléculas (como DNA e proteínas) essa sedimentação não é perceptível e se mantém distribuída na solução. Mas, quando são aplicadas altas acelerações, o comportamento de sedimentação das macromoléculas irá lembrar aquele dos grãos de areia.
Assim, a aceleração centrífuga ocasiona o aumento do efeito da sedimentação pela gravidade. Por essa razão, a centrifugação é tão utilizada nos processos laboratoriais para separação de misturas e purificação de partículas biológicas.
Tipos de separação por centrifugação
A obtenção de amostras adequadas para a fase analítica requer vários processos de separação que irão basear-se nas propriedades e tipos celulares presentes. As etapas de centrifugação com diferentes velocidades permitem obter diferentes frações de células ou tecidos. A centrifugação por gradiente de densidade é o método que melhora muito a eficiência da separação.
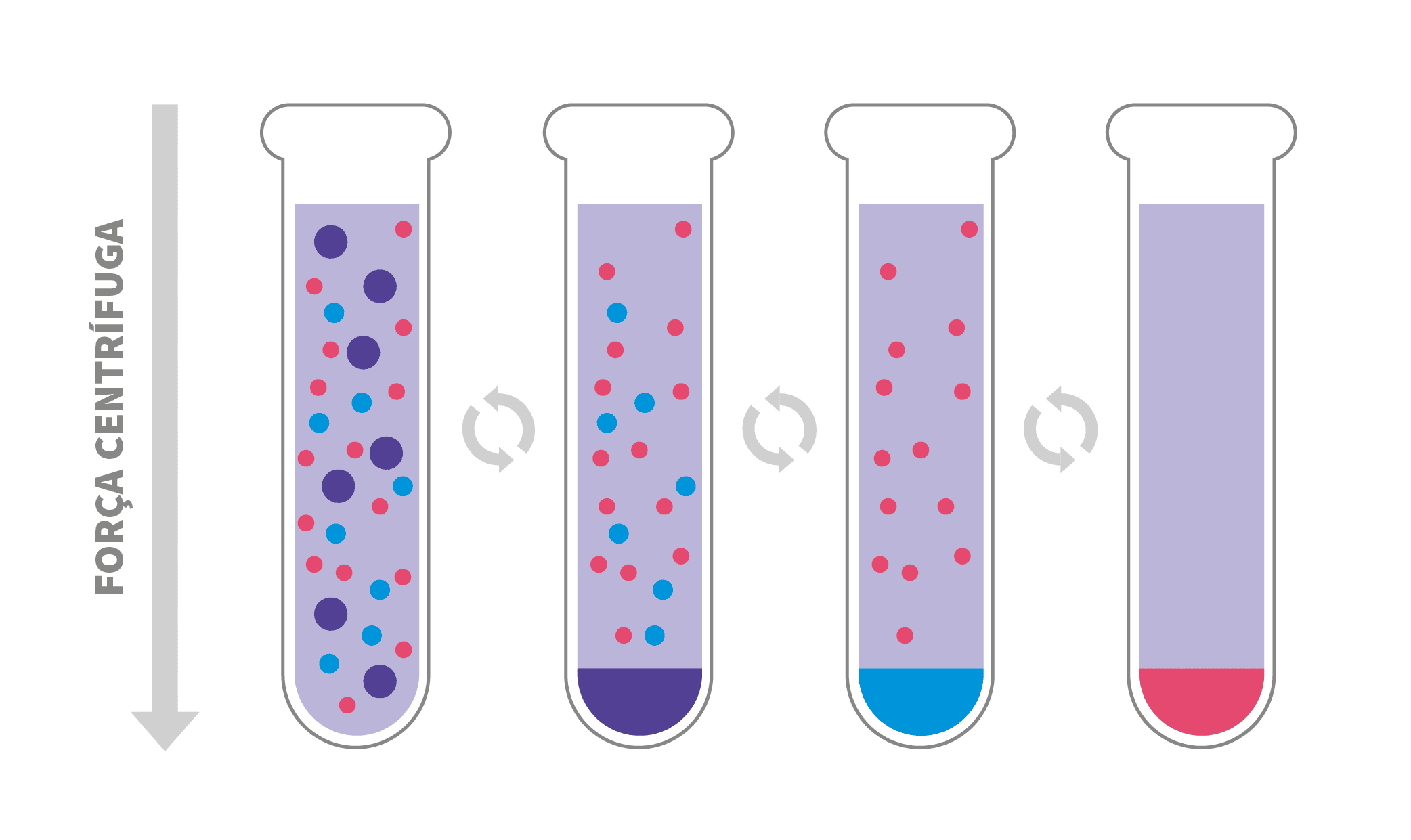
Existem dois tipos de técnicas centrífugas para separação de partículas, centrifugação diferencial e centrifugação por gradiente de densidade.
A centrifugação por gradiente de densidade pode ainda ser dividida em centrifugação zonal e isopícnica.
Centrifugação diferencial
Na centrifugação diferencial a separação é baseada no tamanho das partículas. Uma suspensão contendo diferentes moléculas é centrifugada e as partículas maiores sedimentam com mais rapidez do que as partículas menores. Dessa forma, partículas com densidades e tamanho diferentes sedimentarão em taxas diferentes.
São realizadas sucessivas centrifugações em velocidade crescente. Em cada etapa, apenas duas frações são formadas: o sedimento ou pellet (o que permanece compactado no fundo) e o sobrenadante. A primeira centrifugação tem velocidade mais lenta e o pellet é formado pelas partículas maiores. A centrifugação subsequente com uma força centrífuga mais alta granulará partículas com um tamanho inferior e assim por diante.
Por exemplo, na amostra centrifugada a 1.000 x g por 10 minutos, células intactas e núcleos densos formam o pellet. O sobrenadante pode ser centrifugado novamente a 10.000 x g por 20 minutos e terá pellet formado por mitocôndrias e lisossomos.
Exemplos de aplicação
Peletização de células e bactérias de um meio em crescimento, coleta de DNA precipitado.
Centrifugação por gradiente de densidade
Na centrifugação por gradiente, as partículas sob força centrífuga se depositam através do gradiente, concentrando-se em zonas ou bandas.
O gradiente de densidade é criado por concentrações crescentes de uma substância adequada para o experimento (como sacarose ou cloreto de césio), formando assim um gradiente de concentração.
Esse tipo de centrifugação é útil para purificar partículas, como organelas ou macromoléculas. São subdivididas ainda em dois tipos: escala zonal (tamanho) e isopícnica (densidade).
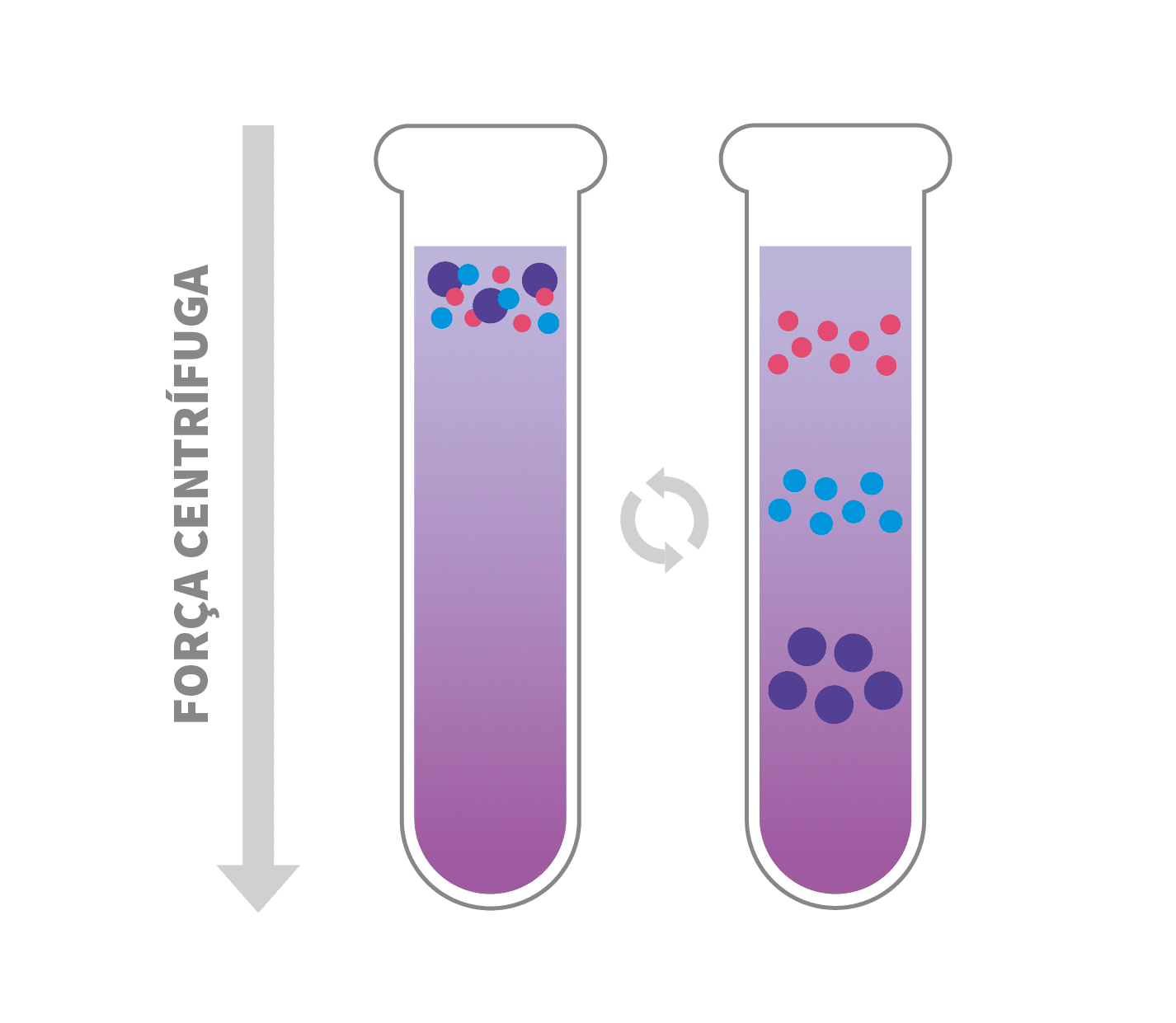
Gradiente de densidade de Escala Zonal
A centrifugação por gradiente de densidade de escala zonal separa partículas que possuem densidades similares e massas diferentes.
O gradiente estabiliza as bandas e fornece um meio de densidade e viscosidade crescentes. Sua finalidade é permitir a passagem suave pelas várias zonas, diminuindo a mistura das soluções. A amostra é colocada cuidadosamente no topo do tubo com o gradiente de densidade.
Durante a centrifugação, cada partícula sedimenta com uma velocidade que depende principalmente da sua massa e tamanho. As zonas são formadas por partículas de tamanhos semelhantes, conforme as partículas de sedimentação mais rápida se movem frente às mais lentas. No final, as partículas separadas em zonas são coletadas.
O tempo interfere muito nesse processo, a centrifugação deve ser interrompida assim que as partículas forem separadas, ou seja, antes que atinjam o fundo do tubo.
Exemplos de aplicação
Isolamento de subunidades ribossomais em um gradiente de sacarose.
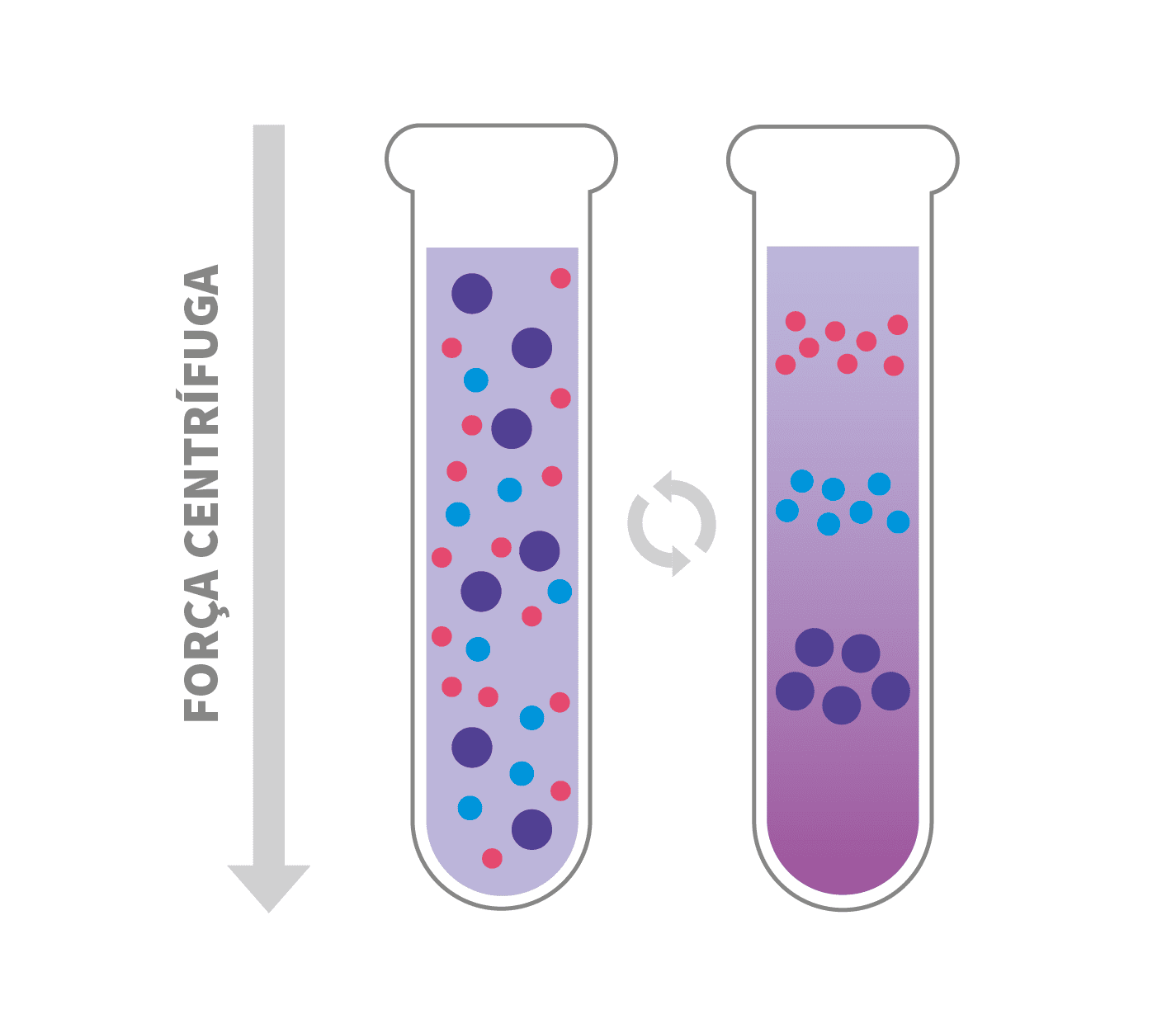
Gradiente de densidade Isopícnica ou de Equilíbrio
A centrifugação por gradiente de densidade isopícnica (do grego “isos” igual e “pyknos” denso, ou seja, de igual densidade) separa partículas de tamanhos semelhantes, porém com densidades diferentes.
A amostra é misturada em uma solução com gradiente de densidade conhecido, igual a densidade média das partículas. A solução é submetida à centrifugação até que a solução chegue ao equilíbrio, ou seja, no ponto em que as densidades são iguais. Cada partícula migra para a posição em que o gradiente de densidade é igual a ela, formando assim as bandas nesses locais.
O tempo de centrifugação não interfere nesse processo, uma vez que quanto a partícula atinge seu ponto de equilíbrio permanece nessa região, não sedimentando para o fundo do tubo.
Exemplos de aplicação
Separação de ácidos nucleicos em gradiente de cloreto de césio (CsCl).
Linha de produtos Kasvi:
Referências
- BRUNO, Alessandra Nejar. Biotecnologia I. ArtMed, 2014.
- Karp, Gerald Biologia celular e molecular. 3ª edição. Manole, 2005.
- VOET, Donald, VOET, Judith G. Bioquímica, 4ª edição. ArtMed, 2013.
- BARKER, Kathy. Na bancada: manual de iniciação científica em laboratórios de pesquisas biomédicas. Porto Alegre: Artmed, 2002.