Análise físico-química de vinhos
7 min de leitura
O Brasil produz cerca de 1,5 milhões de toneladas de uvas por ano, segundo informações da Embrapa. Cerca de 50% das uvas são destinadas para elaboração de vinhos, sucos e outros derivados, e os outros 50% comercializado como uvas de mesa. Para que estas bebidas cheguem com qualidade até o consumidor, são realizadas análises físico-químicas do vinho e derivados.
Do total de produtos industrializados no país, 42% são vinhos de mesa e 49% são sucos de uva. A análise física e química de vinhos são uma exigência legal e fundamentais para o controle de qualidade para a detecção de eventuais falhas que podem ocorrer na cadeia produtiva.
Confira quais são algumas análises mais comuns que fazem parte do processo industrial do vinho.
Teor alcoólico
O grau alcoólico corresponde ao número de litros de álcool etílico em 100 litros de vinho. A medida deve ser efetuada a 20 ºC.
O método utilizado para chegar ao teor alcoólico do vinho é a destilação do vinho previamente alcalinizado e posterior medida do grau alcoólico por densimetria (densímetro Anton Paar).
Materiais e equipamentos utilizados:
• Aparelho de destilação
• Balão volumétrico de 50 mL.
• Densímetro Anton Paar DMA 45.
Reagente: Óxido de cálcio (120 g L -1)
Procedimento
Medir 50 mL de vinho num balão volumétrico limpo e seco e aferir a temperatura de 20 ºC. Transferir a amostra de vinho para um balão destilatório. Lavar o balão volumétrico de 50 mL que continha o vinho com água destilada e juntar ao conteúdo do balão de destilação.
Adicionar ao balão de destilação 10 mL da solução de óxido de cálcio, para neutralizar a acidez do vinho e evitar a passagem dos ácidos voláteis ao destilado, o que provocaria um aumento da densidade e consequente diminuição do grau alcoólico. Conectar o balão de destilação ao condensador e colocar o balão de 50 mL com 2 mL de água destilada na extremidade do condensador para receber o destilado, mantendo-o em um recipiente com gelo para evitar a perda do álcool. Recolher três quartos do volume inicial. Completar o volume com água destilada ajustando-a à mesma temperatura inicial e agitar.
Em vinhos com teor de açúcar elevado, recomenda-se utilizar algumas gotas de solução antiespumante, evitando o transbordamento durante a ebulição. Determinar a densidade do destilado a 20 ºC no densímetro Anton Paar DMA 45 e fazer a leitura do grau alcoólico do vinho.
Acidez total
A acidez total corresponde à soma dos ácidos tituláveis quando se neutraliza o vinho até pH 7,0 com solução alcalina.
A titulação é feita com hidróxido de sódio 0,1 N, utilizando o azul de bromotimol como indicador do final da reação, até o aparecimento de cor azul.
Material
• Erlenmeyer de 250 mL.
• Bureta de 25 mL.
Reagentes: Hidróxido de sódio 0,1 N e Azul de bromotimol: 4 g L -1 diluído no álcool a 20%.
Procedimento
Em um Erlenmeyer de 250 mL, adicionar 5 mL de vinho e 100 mL de água destilada e algumas gotas de azul de bromotimol. Titular com hidróxido de sódio 0,1 N até o aparecimento da coloração azul, tendo o cuidado de anotar o volume gasto (mL).
Cálculo do resultado
A acidez total em meq L¹ é obtida por meio da seguinte fórmula:

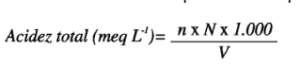
n = mililitros de hidróxido de sódio gastos na titulação
N = normalidade do hidróxido de sódio
V = volume de vinho utilizado em mL
pH do vinho
O pH representa a concentração de íons de hidrogênio livres dissolvidos no vinho. O valor é expresso pelo logaritmo da concentração de íons hidrogênio, que, no caso dos vinhos brasileiros, é variável de 3,0 até 3,8, dependendo do tipo de vinho (branco ou tinto), do cultivo e da safra.
O pH dos vinhos brasileiros variam entre 3,0 a 3,8.
Para chegar ao resultado, baseia-se na diferença de potencial entre dois eletrodos mergulhados na amostra de vinho em análise. Um eletrodo de referência com um potencial constante e outro de medida, com um potencial determinado pelo pH do meio.
Material e equipamento
• Medidor de pH (pHmetro) de leitura digital com precisão de 0,01 unida- des.
• Eletrodos de vidro – em geral são utilizados combinados, por conterem em uma só peça o eletrodo de medida e o de referência. Deverão ser conservados submersos em solução de cloreto de potássio 3M.
• Termômetro de 0 ºC a 50 ºC.
Reagentes
• Solução tampão de pH 3,0.
• Solução tampão de pH 4,0, ou uma solução saturada de tartarato ácido de potássio (5,7 g L-1) com pH de 3,57 a 20 ºC e pH 3,56 a 25 ºC.
Procedimento
O aparelho deve ser calibrado com soluções tampão à temperatura de 20 ºC. Mergulhar o eletrodo na solução tampão de pH 4,0 e, com o comando correspondente de calibração, situar o valor de pH do padrão no visor do aparelho. Depois, mergulhar o eletrodo na solução tampão de pH 3,0 e comprovar se o medidor indica corretamente esse valor; caso contrário, com o comando correspondente de calibração, situar o valor de pH do padrão no visor do aparelho.
Efetuar as operações de calibração até quando as leituras no visor corresponderem aos valores dos padrões.
Lavar novamente o eletrodo com água destilada. Introduzir o eletrodo na amostra até a altura aproximada de 1 cm acima do diafragma. Aguardar a estabilização do aparelho e anotar a leitura que indicará o pH da amostra de vinho. Lavar o eletrodo com água destilada e mergulhar na solução de descanso.
Cálculo do resultado
O resultado da leitura do pH é feita diretamente considerando o resultado apresentado no pHmetro.
Açúcares redutores
Os açúcares redutores são aqueles que, quando aquecidos em meio alcalino e na presença de minerais (geralmente o cobre), têm a propriedade de reduzir esses metais. A reação do açúcar contido no vinho com o cobre presente em uma solução cuproalcalina. Os íons cúpricos em excesso são determinados por iodometria.
Material e equipamento
• Erlenmeyer de 250 mL.
• Bureta graduada de 25 mL.
• Copo de béquer.
• Funil de vidro.
• Bico de Bunsen.
• Balão volumétrico de 100 mL.
• Pipetas volumétricas de 2 mL, 5 mL, 10 mL, 20 mL e 50 mL.
Reagentes
• Fehling A – diluir 69,3 g de sulfato de cobre penta-hidratado (CuSO 4.5H 2O) num balão volumétrico de 1 L, com água destilada.
• Fehling B – diluir 346 g de sal de Seignette (tartarato duplo de sódio e potássio) e 103 g de hidróxido de sódio num balão volumétrico de 1 L, com água destilada.
• Solução de iodeto de potássio a 30%.
• Solução de ácido sulfúrico (D=1,84) a 17%.
• Solução de tiossulfato de sódio 0,1 N.
• Solução de amido a 1%.
Procedimento
Em um Erlenmeyer de 250 mL, adicionar 10 mL de Fehling A, 10 mL de Fehling B e 20 mL do vinho previamente diluído. Colocar sobre o Erlenmeyer um funil de vidro para refrigeração em refluxo, aquecer até a fervura sobre tela de amianto e prolongar por mais dois minutos. Esfriar a solução até no mínimo 15 ºC. Adicionar 3 mL de iodeto de potássio a 30%, 10 mL de ácido sulfúrico a 17% e lavar as paredes do Erlenmeyer com água destilada. Titular com tiossulfato de sódio 0,1 N, utilizando como indicador 2 mL de amido a 1%, que forma um complexo de cor lilás e que passa para uma coloração esbranquiçada no momento da viragem, anotando os mililitros gastos (n’).
O amido deve ser adicionado quando o meio é suficientemente pobre em iodo (no final da reação), uma vez que com o excesso de iodo forma um complexo irreversível que consome iodo e torna a viragem menos nítida.
Existem ainda a análise do extrato seco, sulfatos e cloretos e também a possibilidade de realizar cromatografia em meio gasoso e cromatografia de alta eficiência para análise dos ácidos presentes no vinho.
Fonte: RIZZON, Luiz Antenor Metodologia para análise de vinho. Embrapa Informação Tecnológica Brasília, DF, 2010.
Relacionados

Obrigado!
Aguarde os próximos passos, logo nossa equipe entrará em contato.
por gentileza, preencha os campos abaixo.