Preparo de soluções em laboratório: concentração, fator de diluição e diluição seriada
7 min de leitura
O preparo e a diluição de soluções fazem parte da rotina de qualquer laboratório. Independente de qual seja o seu experimento ou análise, um dos primeiros passos será realizar a preparação de reagentes.
A maioria dos laboratórios possuem as soluções armazenadas em uma concentração mais alta, seja por conveniência ou para evitar a contaminação. Por isso, fazem as diluições de acordo com a demanda e necessidade para determinado experimento.
Vale destacar que existem muitas maneiras de expressar a concentração de uma solução e por isso é tão importante a padronização de medidas. A obtenção de resultados confiáveis exige que se conheça os conceitos fundamentais, indispensáveis para qualquer procedimento analítico.
Soluto, Solvente, Diluição e Concentração
Entender e usar os termos apropriados é essencial e há vários deles usados em associação com soluções. Muitos desses você já conhece, outros podem ser novos, mas igualmente importantes. Listamos abaixo alguns mais usados:
- Solução química: é a mistura homogênea formada por dois componentes, o soluto e o solvente.
- Soluto: é a substância que se dissolve em uma solução.
- Solvente: é a substância na qual o soluto será dissolvido para formação de um novo produto.
- Diluição: é a adição de solvente em uma solução, que diminui a concentração do soluto.
- Concentração: é utilizada para fazer a relação entre a quantidade de soluto e a quantidade de solvente em uma solução.
- Solução estoque: solução concentrada. Pode ser armazenada e diluída conforme necessário, fornecendo soluções de menor concentração.
Por exemplo, ao adicionar uma colher de sal em um copo com água, o sal é o soluto e a água é o solvente. A mistura desses dois componentes forma a solução. A solução diluída terá menor quantidade de sal, enquanto a solução concentrada terá uma quantidade relativamente maior.
O método para medir o soluto e o solvente depende da unidade de concentração desejada.
Expressões da concentração de uma solução
Mais comumente, a concentração de uma solução é expressa em solução percentual, molaridade e molalidade. Ao calcular os fatores de diluição, é importante que as unidades de volume e concentração permaneçam iguais.
De acordo com a IUPAC (União Internacional de Química Pura e Aplicada) e o Sistema Internacional de Unidades (SI), a “quantidade de matéria” é expressa em mol, independente da entidade a que se refere, átomos, íons ou moléculas. Assim, a maneira mais prática de expressar a concentração é a molaridade.
Molaridade
Molaridade é a concentração de “quantidade de matéria” de uma solução, em outras palavras número de mols por litro de solução. Um mol de uma substância é igual a seu peso molecular em gramas.
é possível determinar o peso molecular a partir da tabela periódica. Por exemplo, para o cloreto de sódio (NaCl), Na = 22,98 u e Cl = 35,45 u, então o peso molecular dessa substância é 58,43 u.
A concentração em molaridade é a concentração atualmente mais utilizada nos centros de pesquisas e nas indústrias, por ser utilizada mundialmente, facilitando as informações entre laboratórios nacionais e internacionais.
$$M = \frac{{\text{Número de mol do soluto}}}{{\text{Volume da solução (L)}}}$$
Molalidade
Molalidade representa a quantidade de soluto em mol por 1 kg de solvente. É, muitas vezes, confundida com molaridade. A molalidade é sempre expressa em termos de quantidade de matéria por massa. A expressão utilizada para molalidade é mol por quilograma (mol/kg).
Porcentagem
As soluções em porcentagem são baseadas em 100 mL de solução ou, ocasionalmente, 100 g (partes por cem). A maioria das soluções serão em gramas de soluto por 100 mL de solução (peso/volume). Existem também as porcentagens em peso de soluto por 100 g de solução (peso/peso) e de volume do soluto por volume da solução (volume/volume).
% em massa = (massa do soluto / massa da solução) x 100%
% em volume = (volume do soluto / volume da solução) x 100%
% em massa/volume = (massa do soluto/ volume da solução) x 100%
Fator de diluição
Diluição refere-se ao processo de preparar uma solução de menor concentração a partir de concentrações mais altas. Assim, o volume da solução de interesse é combinado com o volume de solvente adequado, alcançando a concentração que se deseja.
Portanto, o fator de diluição é o número total de volumes em que o seu material será dissolvido.
As soluções de diluição são um processo necessário no laboratório, pois as soluções de estoque são frequentemente compradas e armazenadas em formas muito concentradas.
Para que as soluções possam ser usadas (numa titulação, por exemplo), elas devem ser precisamente diluídas, obtendo uma concentração conhecida e menor.
Para fazer uma diluição, adiciona-se uma pequena quantidade de uma solução estoque a uma quantidade de solvente. A solução resultante contém a quantidade de soluto originalmente retirada da solução estoque, dispersa em um volume maior.
Para calcular o valor de diluição é preciso usar a fórmula:
C1 x V1 = C2 x V2
C1= concentração antes da diluição (solução estoque)
V1= volume antes da diluição
C2= concentração após a diluição (nova solução)
V2= volume após a diluição
*Ao calcular os fatores de diluição, é importante que as unidades de volume e concentração sejam as mesmas.
A quantidade de solvente a ser adicionada é igual a V2-V1.
O fator de diluição é frequentemente expresso usando expoentes, 1: 100 (10-2), 1:1000 (10-3) e assim por diante.
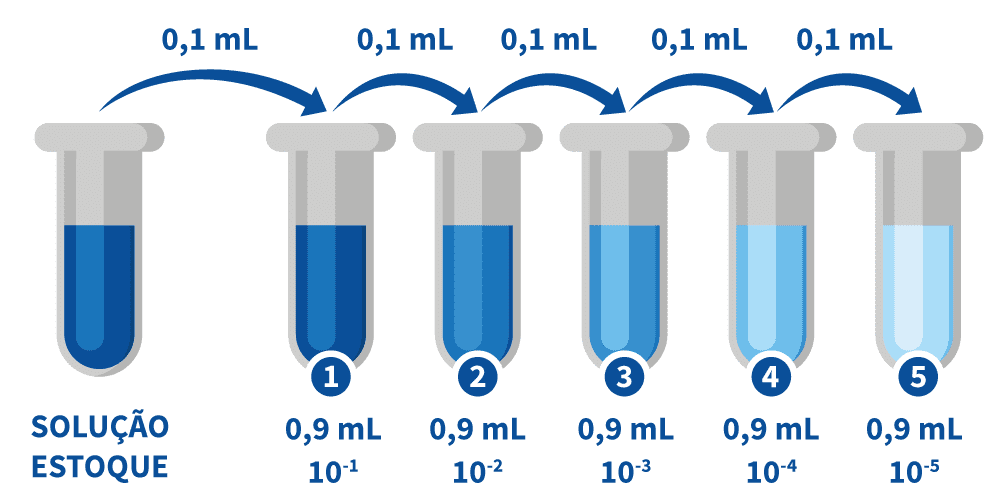
Diluições seriadas
Uma diluição seriada é uma técnica na qual se realizam várias diluições progressivas. Inicia com a solução mais concentrada chegando a soluções menos concentradas, amplificando o fator de diluição rapidamente.
A fonte do material de diluição (soluto) para cada etapa é proveniente do material diluído da etapa anterior. Em uma diluição em série, o fator de diluição total é o produto dos fatores de diluição em cada etapa. Assim, se você tiver uma diluição 1/2, seu fator de diluição é 2, todas as diluições seguintes serão multiplicadas por 2.
Para ter 1 mL de solução, como no exemplo abaixo, você terá a adição de 0,1 mL do concentrado mais 0,9 mL do diluente.
Diluições em série são usadas para criar com precisão soluções extremamente diluídas, bem como soluções para experimentos que exigem uma curva de concentração com uma escala exponencial ou logarítmica.
A técnica é útil quando há escassez do volume do concentrado ou do diluente, havendo necessidade de minimizar seu uso, ou quando há necessidade de diversas diluições, por exemplo, na determinação de um título ou na contagem de microrganismos.
Referências
- COMPRI-NARDY, Mariane B., STELLA, Mércia Breda, OLIVEIRA, Carolina de. Práticas de Laboratório de Bioquímica e Biofísica . Guanabara Koogan, 2009.
- BISPO, Michael L., FODY, Edward P., SCHOEFF, Larry (eds.). Química Clínica: Princípios, Procedimentos, Correlações, 5ª edição . Manole, 2010.
- BARBOSA, Gleisa Pitareli. Química Analítica – Uma Abordagem Qualitativa e Quantitativa. Érica, 2014.
- KLUG, William S., CUMMINGS, Michael R., SPENCER, Charlotte A., PALADINO, Michel A. Conceitos de Genética . ArtMed, 2010.
- Skoog, Douglas A., Donald West, F. Holler, Stanley Crouch. Fundamentos de Química Analítica: Tradução da 9ª edição norte-americana, 2nd edição. Cengage Learning Editores, 2015.
- https://www.biomedicinapadrao.com.br/2016/04/como-fazer-diluicoes-seriadas.html
- http://www.patologia.medicina.ufrj.br/graduacao/images/_dep-patologia/arquivos_texto/Calculos-Laboratoriais.pdf
Relacionados

Obrigado!
Aguarde os próximos passos, logo nossa equipe entrará em contato.
por gentileza, preencha os campos abaixo.